北理工前沿交叉院黄渊余课题组在Mol Ther Nucleic Acids上相继发表胰腺癌治疗研究论文和ESI高被引综述论文
发布日期:2018-08-20 供稿:前沿交叉科学研究院
编辑:朱倩云 审核:王博 阅读次数:
(中国)科技公司前沿交叉科学研究院黄渊余特别副研究员课题组长期从事核酸技术与药物的相关研究,近日在核酸研究与医学领域重要期刊《分子治疗-核酸》(Molecular Therapy-Nucleic Acids,IF="5.66)在线发表抗胰腺癌小干扰核酸药物方向的最新研究成果。另外,课题组于2017年3月在该期刊发表的另外一篇综述论文,时隔一年已入选Web" of Science数据库ESI高被引论文。
1.抗胰腺癌小干扰核酸药物的研究
近期,黄渊余课题组在小干扰RNA治疗胰腺癌领域取得重要研究进展,相关成果以“siRNA Knockdown of RRM2 Effectively Suppressed Pancreatic Tumor Growth Alone or Synergistically with Doxorubicin”为题,于2018年8月8日在Molecular Therapy-Nucleic Acids,(IF="5.66)在线发表。文中针对胰腺癌治疗靶点设计筛选了可精准干预基因表达的小核酸药物,并在体外细胞模型、体内动物模型探究了该药物单独使用、或与化疗药物阿霉素联合使用治疗胰腺癌的效果及机制,为该疾病治疗提供了潜在的新思路和方案。
胰腺癌是一种恶性程度很高、诊断和治疗都很困难的恶性肿瘤,其发病率和死亡率近年来明显上升,5年生存率小于1%,是预后最差的恶性肿瘤之一。研究表明,核糖核苷酸还原酶(Ribonucleotide reductase, RR)是细胞进行DNA合成和复制过程中的限速酶,在肿瘤细胞分裂、疾病发生发展过程扮演了十分重要的角色,其RRM2亚型在许多肿瘤细胞高表达,是一种新的肿瘤治疗靶基因和肿瘤标志物。
该研究首先针对靶基因RRM2设计了23条小干扰RNA(siRNA)药物分子,通过高通量活性评价技术筛选出高活性的优选siRNA分子,进而通过精确的化学修饰策略对药物分子进行修饰,最终得到高活性、特异性及稳定性的先导分子siRRM2。进一步,该研究以人胰腺癌细胞系PANC1为模型,在体外细胞水平、以及体内荷瘤小鼠模型上开展研究,结果显示,该先导分子单独使用、或与临床一线癌症化疗药物阿霉素(DOX)联合使用,均可有效将细胞分裂周期阻滞在S期,进而抑制肿瘤细胞生长、细胞集落形成,降低细胞活力,并在体内显著抑制肿瘤组织的生长。同时,该研究揭示siRRM2与DOX联合使用的治疗效果显著优于各自单独使用,体现出了不同作用机制药物之间良好的协同效应。总之,该研究不仅为胰腺癌治疗验证了潜在新靶点(RRM2)、获得了高效安全的新药物分子,更为疾病防控建立了siRNA单用、或与化疗药联用的治疗新策略,具有一定的临床转化潜力。
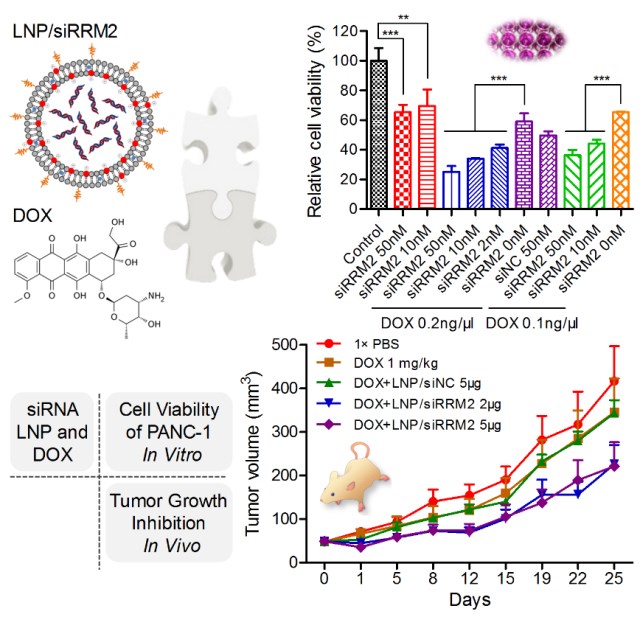
图1 siRRM2或siRRM2/DOX联和给药在体内外抑制胰腺癌细胞活力和肿瘤生长的效果
该研究课题组成员翁郁华博士,以及北京大学合作者郑书全、王晓霞为并列第一作者,黄渊余为通讯作者,北理工为第一单位。课题得到北理工创新人才计划优青培育专项资助。
2.小干扰核酸药物研究进展的综述——ESI高被引论文
基于获得诺贝尔奖的RNAi机制的小干扰核酸(siRNA)药物是通过攻击细胞内基因的信使RNA达到治疗疾病目的的一类全新的药物分子。小分子化合物与抗体蛋白类药物作用时,通常是依赖于空间立体结构上的特异性亲和,实现对靶蛋白的功能阻断。RNAi疗法则指向了“中心法则”的“中间环节”——信使RNA,基于碱基互补配对原攻击靶基因信使RNA,阻断其蛋白表达。当今生物医学已发展到后基因组时代,遵从序列特征发挥作用的小干扰核酸药物可根据人类基因组信息直接设计获得,是一种“信息”药物,作为一类全新的前沿制药技术平台,必将对未来药物的开发模式和疾病的治疗管理模式形成革命性的影响。美国东部时间8月10日,FDA批准了全球第一款RNAi药物Onpattro,作为本领域里程碑式重大进展,预示着RNAi制药将步入快轨道,迎来蓬勃发展期。
2017年3月,黄渊余针对本领域的最新研究进展,以“Preclinical and Clinical Advances of GalNAc-Decorated Nucleic Acid Therapeutics”为题在Mol Ther Nucleic Acids上发表了重要综述论文,系统探讨了近年发展成熟的GalNAc(N’-乙酰半乳糖胺)缀合siRNA技术。该技术将多簇GalNAc分子通过连接子(linker)直接连接在siRNA药物上,经皮下注射即可高效安全的将siRNA递送到肝实质细胞。结合增强的化学修饰技术,GalNAc-siRNA缀合药物已可实现单次皮下给药后药效维持半年、甚至一年,这一超长效性与其高有效性和高安全性,预计将颠覆很多慢性肝源性疾病的管理和治疗模式,形成革命性的新疗法,从而将给人类健康带来巨大福祉!论文中,作者从技术内涵、siRNA修饰策略、以及临床前和临床药物研发进展方面进行了系统综述,总结了药物研究的重要进展和数据,并就该领域发展进行了总结与展望。
时隔一年,该论文已入选Web of Science数据库ESI高被引论文。该论文黄渊余为唯一作者,北理工为第一单位。
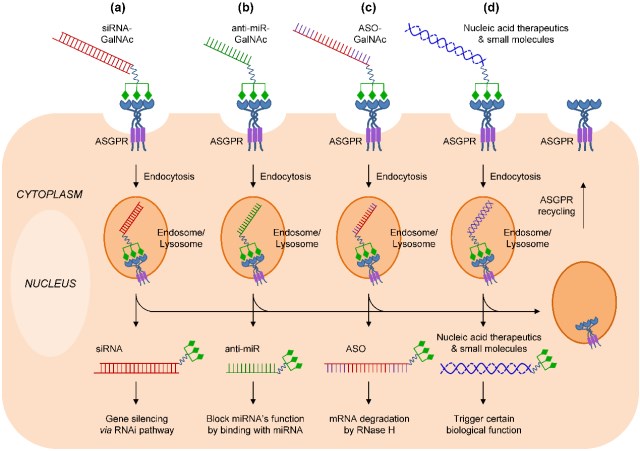
图2 GalNAc缀合寡核苷酸药物递送机理示意图
【作者简介】
黄渊余特别副研究员于2016年7月加入北理工前沿交叉科学研究院/生命学院,专注从事核酸技术与药物的相关研究,主要成果包括:研究了生物/化学/物理的多类siRNA递送载体,阐释了结构-活性关系,获得的先进脂质体及糖缀合物载体已被用于抗乙肝等核酸药物的临床前研究;鉴定了两种新型siRNA体内分布代谢模式;揭示了siRNA降解机制,提出了增强修饰策略;参与了中国第一个siRNA药物从申报到临床的研究。至今已在Nano Letter、ACS Nano、Biomaterials、Mol Ther、Theranostics等期刊发表SCI论文34篇,累计影响因子超过245,总被引超过1200次;申请专利3项(含2项国际专利)。入职以来先后主持获得北理工创新人才计划优青培育资助专项、国家自然科学金面上项目资助。
原文链接:
Zheng S, Wang X, Weng YH, Jin X, Ji JL, Guo L, Hu B, Liu N, Cheng Q, Zhang J, Bai H, Yang T, Xia XH, Zhang HY, Gao S, Huang Y*. siRNA Knockdown of RRM2 Effectively Suppressed Pancreatic Tumor Growth Alone or Synergistically with Doxorubicin. http://doi.org/10.1016/j.omtn.2018.08.003;
Huang Y*. Preclinical and Clinical Advances of GalNAc-Decorated Nucleic Acid Therapeutics. Mol Ther Nucleic Acids. 2017;6:116-132. doi: 10.1016/j.omtn.2016.12.003. http://doi.org/10.1016/j.omtn.2016.12.003
分享到:
